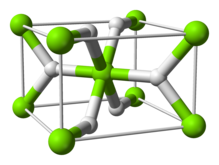
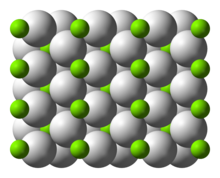
മഗ്നീഷ്യം ഹൈഡ്രൈഡ്
ദൃശ്യരൂപം
| |
| |
| Names | |
|---|---|
| IUPAC name
Magnesium hydride
| |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.028.824 |
| EC Number |
|
PubChem CID
|
|
| InChI | |
| SMILES | |
| Properties | |
| തന്മാത്രാ വാക്യം | |
| Molar mass | 0 g mol−1 |
| Appearance | white crystals |
| സാന്ദ്രത | 1.45 g/cm3 |
| ദ്രവണാങ്കം | |
| decomposes | |
| Solubility | insoluble in ether |
| Structure | |
| tetragonal | |
| Thermochemistry | |
| Std enthalpy of formation ΔfH |
-75.2 kJ/mol |
| Standard molar entropy S |
31.1 J/mol K |
| Specific heat capacity, C | 35.4 J/mol K |
| Hazards | |
| Main hazards | pyrophoric[1] |
| Related compounds | |
| Other cations | Beryllium hydride Calcium hydride Strontium hydride Barium hydride |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
MgH2 എന്ന തന്മാത്രാ സൂത്രവാക്യമുള്ള രാസ സംയുക്തമാണ് മഗ്നീഷ്യം ഹൈഡ്രൈഡ് . ഹൈഡ്രജന്റെ ഭാരം അനുസരിച്ച് 7.66% പദാർത്ഥം ഇതിൽ അടങ്ങിയിരിക്കുന്നു. ഇത് ഒരു ഹൈഡ്രജൻ സംഭരണ മാധ്യമമായി വിശേഷിപ്പിക്കപെടുന്നു. [2]
തയ്യാറാക്കൽ
[തിരുത്തുക]1951-ൽ മൂലകങ്ങളിൽ നിന്നുള്ള തയ്യാറാക്കൽ ആദ്യമായി റിപ്പോർട്ട് ചെയ്തു. ഉയർന്ന മർദ്ദത്തിലും താപനിലയിലും (200 അന്തരീക്ഷം, 500 ° C) മഗ്നീഷ്യം ഒരു ഉൽപ്രേരകത്തിന്റെ സാന്നിദ്ധ്യത്തിൽ ഹൈഡ്രജനേഷൻ നടത്തിയാണ് നിർമാമണം: [3]
- Mg + H 2 → MgH 2
- മിതമായ അവസ്ഥയിൽ മഗ്നീഷ്യം ആന്ത്രാസീന്റെ ഹൈഡ്രജനേഷൻ മറ്റൊരു മാർഗ്ഗമാണ്: [4]
- Mg (ആന്ത്രാസിൻ) + H 2 → MgH2
പ്രതിപ്രവർത്തനം
[തിരുത്തുക]MgH2 വെള്ളവുമായി പെട്ടെന്ന് പ്രതിപ്രവർത്തിച്ച് ഹൈഡ്രജൻ വാതകം ഉണ്ടാക്കുന്നു:
- MgH 2 + 2 H 2 O → 2 H 2 + Mg (OH) 2
അവലംബം
[തിരുത്തുക]- ↑ Michalczyk, Michael J (1992). "Synthesis of magnesium hydride by the reaction of phenylsilane and dibutylmagnesium". Organometallics. 11 (6): 2307–2309. doi:10.1021/om00042a055.
- ↑ Bogdanovic, Borislav (1985). "Catalytic Synthesis of Organolithium and Organomagnesium Compounds and of Lithium and Magnesium Hydrides - Applications in Organic Synthesis and Hydrogen Storage". Angewandte Chemie International Edition in English. 24 (4): 262–273. doi:10.1002/anie.198502621.
- ↑ Egon Wiberg, Heinz Goeltzer, Richard Bauer (1951). "Synthese von Magnesiumhydrid aus den Elementen (Synthesis of Magnesium Hydride from the Elements)" (PDF). Zeitschrift für Naturforschung B. 6b: 394.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Bogdanovi?, Borislav; Liao, Shih-Tsien; Schwickardi, Manfred; Sikorsky, Peter; Spliethoff, Bernd (1980). "Catalytic Synthesis of Magnesium Hydride under Mild Conditions". Angewandte Chemie International Edition in English. 19 (10): 818. doi:10.1002/anie.198008181.
