ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങൾ
| ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങൾ | |
|---|---|
 | |
| Young woman with malar rash, typically found in systemic lupus erythematosus (SLE) | |
| സ്പെഷ്യാലിറ്റി | റുമറ്റോളജി, ഇമ്മ്യൂണോളജി, ഗ്യാസ്ട്രോഎൺട്രോളജി, ന്യൂറോളജി, ഡെർമ്മറ്റോളജി |
| ലക്ഷണങ്ങൾ | നിരവധിയുണ്ട്, അവ അവസ്ഥയെ ആശ്രയിച്ചിരിക്കുന്നു. സാധാരണയായി കാണുന്നവയിൽ കുറഞ്ഞ ഗ്രേഡ് പനി, തളർച്ച എന്നിവയുണ്ട്[1] |
| സാധാരണ തുടക്കം | മുതിർന്നവരിൽ[1] |
| തരങ്ങൾ | List of autoimmune diseases (alopecia areata, celiac disease, diabetes mellitus type 1, Hashimoto's disease, Graves' disease, inflammatory bowel disease, multiple sclerosis, psoriasis, rheumatoid arthritis, systemic lupus erythematosus, others)[1] |
| മരുന്ന് | Nonsteroidal anti-inflammatory drugs, immunosuppressants, intravenous immunoglobulin[1][2] |
| ആവൃത്തി | 24 million / 7% (USA)[1][3] |
സ്വന്തം ശരീരഭാഗത്തിന് എതിരെ ശരീരത്തിലെ തന്നെ രോഗപ്രതിരോധ സവിധാനം പ്രതികരിക്കുന്നത് മൂലം ഉണ്ടാകുന്ന ഒരു അവസ്ഥയാണ് ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങൾ അല്ലെങ്കിൽ സ്വയം രോഗപ്രതിരോധ രോഗങ്ങൾ എന്നറിയപ്പെടുന്നത്.[1] കുറഞ്ഞത് 80 തരം ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങൾ തിരിച്ചറിഞ്ഞിട്ടുണ്ട്, ചില തെളിവുകൾ സൂചിപ്പിക്കുന്നത് ഇവ 100-ലധികം തരങ്ങളുണ്ടാകാം എന്നാണ്.[4][5][6] രോഗം ബാധിക്കുന്ന അവയവങ്ങളിൽ മിക്കവാറും എല്ലാ ശരീരഭാഗങ്ങളും ഉൾപ്പെടാം.[3] സാധാരണ ലക്ഷണങ്ങൾ വ്യത്യസ്തവും ക്ഷണികവുമാകാം. ലക്ഷണങ്ങളിൽ ലഘുവായത് മുതൽ കഠിനമായത് വരെ ഉണ്ട്. കുറഞ്ഞ ഗ്രേഡ് പനിയും ക്ഷീണവും ലക്ഷണങ്ങളിൽ ഉൾപ്പെടുന്നു.[1]
രോഗ കാരണം അജ്ഞാതമാണ്.[3] ലൂപ്പസ് പോലുള്ള ചില ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങൾ കുടുംബങ്ങളിൽ ഉള്ളവർക്ക് പാരമ്പര്യമായി ഉണ്ടാകാറുണ്ട്, ചില കേസുകൾക്ക് അണുബാധകളോ മറ്റ് പാരിസ്ഥിതിക ഘടകങ്ങളോ കാരണമാകാം.[1] സെലിയാക് ഡിസീസ്, ഡയബറ്റിസ് മെലിറ്റസ് ടൈപ്പ് 1, ഗ്രേവ്സ് ഡിസീസ്, ഇൻഫ്ലമേറ്ററി ബവൽ ഡിസീസ്, മൾട്ടിപ്പിൾ സ്ക്ലിറോസിസ്, അലോപ്പീസിയ ഏരിയറ്റ, അഡിസൺസ് രോഗം, പെർണീഷ്യസ് അനീമിയ, സോറിയാസിസ്, റൂമറ്റോയ്ഡ് ആർത്രൈറ്റിസ്, സിസ്റ്റമിക് ല്യൂസ്പസ് എന്നിവ ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങളിൽ ഉൾപ്പെടുന്നു.[1][7] പലപ്പോഴും രോഗങ്ങളുടെ രോഗനിർണയം പ്രയാസമാണ്. [1]
ചികിത്സ രോഗത്തിന്റെ തരത്തെയും തീവ്രതയെയും ആശ്രയിച്ചിരിക്കുന്നു.[1] നോൺസ്റ്ററോയ്ഡൽ ആൻറി-ഇൻഫ്ലമേറ്ററി മരുന്നുകളും (എൻഎസ്എഐഡി) രോഗപ്രതിരോധ മരുന്നുകളും ഈ രോഗ ചികിത്സയ്ക്കായി പലപ്പോഴും ഉപയോഗിക്കുന്നു.[1] ഇൻട്രാവീനസ് ഇമ്യൂണോഗ്ലോബുലിൻ ഇടയ്ക്കിടെ ഉപയോഗിക്കാം.[2] ചികിത്സ പൊതുവേ രോഗലക്ഷണങ്ങൾ മെച്ചപ്പെടുത്തുകയാണ് ചെയ്യുന്നത്, അവ സാധാരണയായി രോഗത്തെ സുഖപ്പെടുത്തുന്നില്ല.[1]
യുണൈറ്റഡ് സ്റ്റേറ്റ്സിലെ ഏകദേശം 24 ദശലക്ഷം (~7.5%) ആളുകൾ ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങൾ ബാധിച്ചവരാണ് എന്ന് കണക്കുകൾ സൂചിപ്പിക്കുന്നു.[1][3] പുരുഷന്മാരേക്കാൾ സ്ത്രീകളെയാണ് രോഗം കൂടുതലായി ബാധിക്കുന്നത്.[1] പലപ്പോഴും അവ പ്രായപൂർത്തിയാകുമ്പോൾ ആരംഭിക്കുന്നു.[1] ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങൾ 1900 കളുടെ തുടക്കത്തിൽ ആണ് ആദ്യമായി വിവരിക്കുന്നത്.[8]
ലക്ഷണങ്ങളും അടയാളങ്ങളും
[തിരുത്തുക]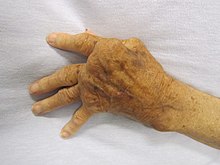
എൺപതിലധികം വ്യത്യസ്ത തരങ്ങളിൽ ചില ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങൾ സമാനമായ ലക്ഷണങ്ങൾ കാണിക്കുന്നു, മറ്റുള്ളവ അങ്ങനെയല്ല. ഉദാഹരണത്തിന്, ടൈപ്പ് 1 പ്രമേഹം റൂമറ്റോയ്ഡ് ആർത്രൈറ്റിസിൽ നിന്ന് വ്യത്യസ്തമാണ്.[9] ഈ അടയാളങ്ങളുടെയും ലക്ഷണങ്ങളുടെയും രൂപവും തീവ്രതയും സംഭവിക്കുന്ന സ്വയം രോഗപ്രതിരോധ പ്രതികരണത്തിന്റെ സ്ഥാനത്തെയും തരത്തെയും ആശ്രയിച്ചിരിക്കുന്നു. ഒരു വ്യക്തിക്ക് ഒരേസമയം ഒന്നിലധികം ലക്ഷണങ്ങൾ ഉണ്ടാകാം, കൂടാതെ ഒന്നിലധികം രോഗങ്ങളുടെ ലക്ഷണങ്ങൾ പ്രകടിപ്പിക്കുകയും ചെയ്യും. രോഗിയിൽ കാണപ്പെടുന്ന അടയാളങ്ങളും ലക്ഷണങ്ങളും, രോഗം തന്നെയും, പ്രായം, ഹോർമോണുകൾ, പാരിസ്ഥിതിക ഘടകങ്ങൾ എന്നിങ്ങനെയുള്ള വിവിധ ഘടകങ്ങളാൽ സ്വാധീനിക്കപ്പെടാം.[10] പൊതുവായ ലക്ഷണങ്ങൾ ഇവയാണ്:[11]
- ക്ഷീണം
- കുറഞ്ഞ ഗ്രേഡ് പനി
- അസ്വാസ്ഥ്യം
- പേശി വേദനയും സന്ധി വേദനയും
- ചർമ്മത്തിന്റെ വിവിധ ഭാഗങ്ങളിൽ ചുണങ്ങു
ഈ അടയാളങ്ങളുടെയും ലക്ഷണങ്ങളുടെയും രൂപത്തിലും അളവിലും ചാഞ്ചാട്ടം ഉണ്ടാകാം, അവ വീണ്ടും പ്രത്യക്ഷപ്പെടുമ്പോൾ, അത് ഫ്ലെയർ-അപ്പ് എന്നറിയപ്പെടുന്നു. ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങളുടെ അടയാളങ്ങൾക്കും ലക്ഷണങ്ങൾക്കും ഒപ്പം ബയോളജിക്കൽ മാർക്കറുകളിൽ നിന്നുള്ള ഫലങ്ങളും അത്തരം രോഗനിർണയത്തെ സഹായിച്ചേക്കാം.[12]
ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങൾ സാധാരണയായി ബാധിക്കുന്ന നിരവധി മേഖലകളുണ്ട്. ഈ മേഖലകളിൽ രക്തക്കുഴലുകൾ, ബന്ധിത ടിഷ്യൂകൾ, സന്ധികൾ, പേശികൾ, ചുവന്ന രക്താണുക്കൾ, ചർമ്മം, എൻഡോക്രൈൻ ഗ്രന്ഥികൾ (തൈറോയ്ഡ് അല്ലെങ്കിൽ പാൻക്രിയാസ് ഗ്രന്ഥികൾ പോലുള്ളവ) എന്നിവ ഉൾപ്പെടുന്നു.
ഈ രോഗങ്ങൾക്ക് അവയെ ഓട്ടോഇമ്മ്യൂൺ രോഗമായി ചിത്രീകരിക്കുന്ന ചില പ്രത്യേക പാത്തോളജിക്കൽ ഇഫക്റ്റുകൾ ഉണ്ട്. അസ്വാഭാവികമായ രോഗപ്രതിരോധ പ്രതികരണം ഉള്ളിടത്ത് ടിഷ്യൂകൾക്ക് കേടുപാടുകൾ സംഭവിക്കുകയോ ടിഷ്യു നശിക്കുകയോ ചെയ്യുക, അവയവങ്ങളുടെ വളർച്ചയിൽ മാറ്റം വരുക, രോഗത്തിന്റെ സ്ഥാനം അനുസരിച്ച് അവയവങ്ങളുടെ പ്രവർത്തനത്തിൽ മാറ്റം വരുക എന്നിവ ഇത്തരം സവിശേഷതകളിൽ ഉൾപ്പെടുന്നു. ചില രോഗങ്ങൾ അവയവങ്ങളെ മാത്രം ബാധിക്കുന്നവയാണ്, അവ ചില ടിഷ്യൂകളെ ബാധിക്കുകയില്ല, മറ്റുള്ളവ ശരീരത്തിലെ പല ടിഷ്യൂകളെയും ബാധിക്കുന്ന വ്യവസ്ഥാപരമായ രോഗങ്ങളാണ്. ഒരു വ്യക്തിയുടെ രോഗം ഈ വിഭാഗങ്ങളിൽ ഏതാണ് എന്നതിനെ ആശ്രയിച്ച് അടയാളങ്ങളും ലക്ഷണങ്ങളും വ്യത്യാസപ്പെടാം.[13]
കാൻസർ
[തിരുത്തുക]ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങളും ക്യാൻസറും തമ്മിലുള്ള മൊത്തത്തിലുള്ള പരസ്പരബന്ധം ചില ഗവേഷണങ്ങൾ കാണിക്കുന്നു. ഒരു ഓട്ടോഇമ്മ്യൂൺ രോഗം ഉണ്ടാകുന്നത് ചില അർബുദങ്ങൾ വികസിപ്പിക്കാനുള്ള സാധ്യത വർദ്ധിപ്പിക്കുന്നു. [14] ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങൾ വിവിധ സംവിധാനങ്ങളിലൂടെ വീക്കം ഉണ്ടാക്കുന്നു, എന്നിരുന്നാലും, വീക്കം സൃഷ്ടിക്കുന്ന രീതി കാൻസർ സാധ്യതയെ കാര്യമായി സ്വാധീനിക്കുന്നില്ല. [14] മറിച്ച്, എല്ലാ ഓട്ടോ ഇമ്യൂൺ രോഗങ്ങളും ക്യാൻസറുമായി ബന്ധപ്പെട്ടിരിക്കുന്ന വിട്ടുമാറാത്ത വീക്കം വർദ്ധിപ്പിക്കുന്നു എന്ന വസ്തുതയെയാണ് കാൻസർ സാധ്യത പ്രധാനമായും ആശ്രയിക്കുന്നത്. [14] സീലിയാക് രോഗം, ഇൻഫ്ലമേറ്ററി ബവൽ ഡിസീസ് ( ക്രോൺസ് രോഗം, വൻകുടൽ പുണ്ണ് ), മൾട്ടിപ്പിൾ സ്ക്ലിറോസിസ്, റൂമറ്റോയ്ഡ് ആർത്രൈറ്റിസ്, സിസ്റ്റമിക് ല്യൂപ്പസ് എറിത്തമറ്റോസസ് എന്നിവയുൾപ്പെടെ കാൻസറുമായി സാധാരണയായി ബന്ധപ്പെട്ടിരിക്കുന്ന ചില ഓട്ടോ ഇമ്മ്യൂൺ രോഗങ്ങൾ ചുവടെയുണ്ട്. [14]
ഉദാഹരണങ്ങൾ
[തിരുത്തുക]ക്യാൻസറുമായി ബന്ധപ്പെടുന്ന ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങളുടെ ഏതാനും ഉദാഹരണങ്ങൾ താഴെ കൊടുക്കുന്നു.
സീലിയാക് രോഗം
[തിരുത്തുക]സെലിയാക് ഡിസീസ് ദഹനനാളത്തിന്റെയും ലിംഫോപ്രോലിഫെറേറ്റീവ് ക്യാൻസറുകളുമായി ശക്തമായി ബന്ധപ്പെട്ടിരിക്കുന്നു. [14] സെലിയാക് രോഗത്തിൽ, ഗോതമ്പ്, ബാർലി, റൈ എന്നിവയിൽ കാണപ്പെടുന്ന ഗ്ലൂറ്റനോടുള്ള ശരീരത്തിന്റെ പ്രതിരോധശേഷി നഷ്ടപ്പെടുന്നതാണ് ഓട്ടോ ഇമ്യൂണിറ്റി പ്രതികരണത്തിന് കാരണമാകുന്നത്.[14] ദഹനനാളത്തിൽ അന്നനാളം, ആമാശയം, ചെറുകുടൽ, വൻകുടൽ, മലാശയം, മലദ്വാരം എന്നിവ ഉൾപ്പെടുന്നതിനാൽ ദഹനനാളത്തിലെ ക്യാൻസറിനുള്ള സാധ്യത ഇത് വർദ്ദിപ്പിക്കുന്നു.[14] ഒരു രോഗി അവരുടെ ഭക്ഷണത്തിൽ നിന്ന് ഗ്ലൂറ്റൻ നീക്കം ചെയ്താൽ ദഹനനാളത്തിലെ ക്യാൻസർ സാധ്യത ഭാഗികമായി കുറയുകയോ ഇല്ലാതാകുകയോ ചെയ്യാം.[14][15] [16] [17] [18] കൂടാതെ, സീലിയാക് രോഗം ലിംഫോപ്രോലിഫെറേറ്റീവ് ക്യാൻസറുമായും ബന്ധപ്പെട്ടിരിക്കുന്നു. [14]
ഇൻഫ്ലമേറ്ററി ബവൽ ഡിസീസ്
[തിരുത്തുക]ഇൻഫ്ലമേറ്ററി ബവൽ ഡിസീസ് (ഐബിഡി) ദഹനനാളത്തിലെ അർബുദങ്ങളുമായും ചില ലിംഫോപ്രൊലിഫെറേറ്റീവ് ക്യാൻസറുമായും ബന്ധപ്പെട്ടിരിക്കുന്നു.[14] ഐബിഡിയെ ക്രോൺസ് രോഗം അല്ലെങ്കിൽ വൻകുടൽ പുണ്ണ് എന്നിങ്ങനെ തരംതിരിക്കാം.[14] രണ്ട് സാഹചര്യങ്ങളിലും, ഐബിഡി ഉള്ള വ്യക്തികൾക്ക് ഗട്ട് മൈക്രോബയോമിൽ അടങ്ങിയിരിക്കുന്ന സാധാരണ ബാക്ടീരിയകളോടുള്ള പ്രതിരോധശേഷി നഷ്ടപ്പെടുന്നു.[14] ഈ സാഹചര്യത്തിൽ, രോഗപ്രതിരോധ വ്യവസ്ഥ ബാക്ടീരിയയെ ആക്രമിക്കുകയും വിട്ടുമാറാത്ത വീക്കം ഉണ്ടാക്കുകയും ചെയ്യുന്നു, ഇത് ക്യാൻസർ സാധ്യത വർദ്ധിപ്പിക്കുന്നു.[14]
മൾട്ടിപ്പിൾ സ്ക്ലിറോസിസ്
[തിരുത്തുക]മൾട്ടിപ്പിൾ സ്ക്ലിറോസിസ് മൊത്തത്തിൽ ക്യാൻസറിനുള്ള സാധ്യത കുറയ്ക്കുന്നതുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു, എന്നാൽ ഇത്കേന്ദ്ര നാഡീവ്യൂഹം ക്യാൻസറിനുള്ള സാധ്യത വർദ്ധിക്കുന്നു, പ്രധാനമായും തലച്ചോറിൽ.[14] മൾട്ടിപ്പിൾ സ്ക്ലിറോസിസ് ഒരു ന്യൂറോ ഡിജനറേറ്റീവ് രോഗമാണ്, അതിൽ ടി-കോശങ്ങൾ - ഒരു പ്രത്യേക തരം രോഗപ്രതിരോധ കോശങ്ങൾ - മസ്തിഷ്ക ന്യൂറോണുകളിലെ പ്രധാനപ്പെട്ട മൈലിൻ ഷീറ്റിനെ ആക്രമിക്കുന്നു. [19] ഇത് നാഡീവ്യവസ്ഥയുടെ പ്രവർത്തനത്തെ കുറയ്ക്കുന്നു, തലച്ചോറിന്റെ വീക്കം, തുടർന്നുള്ള ക്യാൻസർ എന്നിവ ഉണ്ടാക്കുന്നു. [14]
റൂമറ്റോയ്ഡ് ആർത്രൈറ്റിസ്
[തിരുത്തുക]റൂമറ്റോയ്ഡ് ആർത്രൈറ്റിസ് ശരീരത്തിലുടനീളമുള്ള ഫോക്കൽ ക്യാൻസറുകളുമായും അതുപോലെ ലിംഫോപ്രോലിഫെറേറ്റീവ് ക്യാൻസറുമായും സൗമ്യവും എന്നാൽ കാര്യമായതുമായ ബന്ധം കാണിക്കുന്നു.[14] റൂമറ്റോയ്ഡ് ആർത്രൈറ്റിസിൽ, ശരീരത്തിന്റെ സന്ധികളും തരുണാസ്ഥികളും ഉണ്ടാക്കുന്ന കോശങ്ങൾ ആക്രമണത്തിന് വിധേയ മാവുകയും പ്രാദേശിക വീക്കം ഉണ്ടാക്കുകയും ചെയ്യുന്നു.[14] കൂടാതെ, രോഗപ്രതിരോധവ്യവസ്ഥയുടെ വിട്ടുമാറാത്ത വീക്കവും അമിതമായ പ്രവർത്തനവും മറ്റ് കോശങ്ങളുടെ കൂടുതൽ മാരകമായ പരിവർത്തനത്തിന് അനുകൂലമായ ഒരു അന്തരീക്ഷം സൃഷ്ടിക്കുന്നു. ഇത് ശ്വാസകോശത്തിലെയും ചർമ്മത്തിലെയും അർബുദ സാധ്യതയും മറ്റ് ഹെമറ്റോളജിക്കൽ ക്യാൻസറുകളുടെ അപകടസാധ്യതയും വർദ്ധിപ്പിക്കും, ഇവയൊന്നും സന്ധികളുടെ വീക്കം നേരിട്ട് ബാധിക്കില്ല.[20] [21]
സിസ്റ്റമിക് ല്യൂപ്പസ് എറിത്തമറ്റോസസ്
[തിരുത്തുക]സിസ്റ്റമിക് ല്യൂപ്പസ് എറിത്തമറ്റോസസ് ശരീരത്തിലുടനീളമുള്ള ഫോക്കൽ ക്യാൻസറുമായും ലിംഫോപ്രോലിഫെറേറ്റീവ് ക്യാൻസറുമായും ബന്ധപ്പെട്ടിരിക്കുന്നു.[14] സിസ്റ്റമിക് ല്യൂപ്പസ് എറിത്തമറ്റോസസ് ഒന്നിലധികം അവയവ വ്യവസ്ഥകളെ ബാധിക്കുന്നു. രോഗപ്രതിരോധ ശേഷിയിൽ വ്യാപകമായ നഷ്ടമാണ് ഇതിന്റെ സവിശേഷത.[22] ശരീരത്തിലുടനീളമുള്ള വിട്ടുമാറാത്ത വീക്കം മറ്റ് കോശങ്ങളുടെ മാരകമായ പരിവർത്തനത്തെ പ്രോത്സാഹിപ്പിക്കുന്നു, ഇത് വ്യവസ്ഥാപരമായ, ലിംഫോപ്രോലിഫെറേറ്റീവ് ക്യാൻസറുകളുടെ അപകടസാധ്യത വർദ്ധിപ്പിക്കുന്നു.[14] നേരെമറിച്ച്, സിസ്റ്റമിക് ല്യൂപ്പസ് എറിത്തമറ്റോസസ് ചില അർബുദങ്ങളുടെ കുറവുമായും ബന്ധപ്പെട്ടിരിക്കുന്നു. ഈ പ്രദേശങ്ങളിലെ വർദ്ധിച്ച രോഗപ്രതിരോധ നിരീക്ഷണത്തിലൂടെയാണ് ഇത് നന്നായി വിശദീകരിക്കുന്നത്, എന്നിരുന്നാലും, ഈ പ്രദേശങ്ങളിൽ എന്തുകൊണ്ടാണ് കുറവ് അനുഭവപ്പെടുന്നത് എന്നതിനെക്കുറിച്ച് കൃത്യമായി മനസ്സിലാക്കപ്പെട്ടിട്ടില്ല.[14]
അപ്ലാസ്റ്റിക് അനീമിയ
[തിരുത്തുക]അപ്ലാസ്റ്റിക് അനീമിയയിൽ, ആവശ്യമായ അളവിൽ രക്തകോശങ്ങൾ ഉത്പാദിപ്പിക്കുന്നതിൽ ശരീരം പരാജയപ്പെടുന്നു. അസ്ഥിമജ്ജയിൽ രക്തകോശങ്ങൾ ഉത്പാദിപ്പിക്കുന്നത് അവിടെയുള്ള സ്റ്റെം സെല്ലുകളാണ്. അപ്ലാസ്റ്റിക് അനീമിയ, ചുവന്ന രക്താണുക്കൾ, വെളുത്ത രക്താണുക്കൾ, പ്ലേറ്റ്ലെറ്റുകൾ എന്നീ എല്ലാ രക്തകോശങ്ങളുടെയും കുറവിന് കാരണമാകുന്നു.
കാരണങ്ങൾ
[തിരുത്തുക]ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങളുടെ രോഗകാരണം അജ്ഞാതമാണ്.[3] ലൂപ്പസ് പോലുള്ള ചില ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങൾ കുടുംബങ്ങളിൽ പെട്ടവർക്ക് പാരമ്പര്യമായി ഉണ്ടാകാറുണ്ട്, ചില കേസുകൾ അണുബാധകളോ മറ്റ് പാരിസ്ഥിതിക ഘടകങ്ങളോ കാരണവും ഉണ്ടാകാം.[1] 100-ലധികം സ്വയം രോഗപ്രതിരോധ രോഗങ്ങളുണ്ട്. [23] സെലിയാക് ഡിസീസ്, ഡയബറ്റിസ് മെലിറ്റസ് ടൈപ്പ് 1, ഗ്രേവ്സ് ഡിസീസ്, ഇൻഫ്ലമേറ്ററി ബവൽ ഡിസിസ് മലവിസർജ്ജനം, മൾട്ടിപ്പിൾ സ്ക്ലിറോസിസ്, സോറിയാസിസ്, റൂമറ്റോയ്ഡ് ആർത്രൈറ്റിസ്, സിസ്റ്റമിക് ല്യൂപ്പസ് എറിത്തമറ്റോസസ് എന്നിവയാണ് സാധാരണയായി കാണപ്പെടുന്ന ചില ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങൾ.[1] [7]
ജനിതകശാസ്ത്രം
[തിരുത്തുക]സ്വന്തം പ്രതിരോധ സംവിധാനം ശരീരത്തിനുള്ളിലെ ആരോഗ്യമുള്ള മനുഷ്യ കോശങ്ങളെ ആക്രമിക്കുന്ന അവസ്ഥയാണ് ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങൾ എന്നറിയപ്പെടുന്നത്. ഓരോ ഓട്ടോഇമ്മ്യൂൺ രോഗത്തിനും കാരണമാകുന്ന കൃത്യമായ ജീനുകൾ കണ്ടെത്തിയിട്ടില്ല. എന്നിരുന്നാലും, ജീനോം-വൈഡ് അസോസിയേഷൻ സ്കാനുകൾ പോലുള്ള നിരവധി പരീക്ഷണാത്മക രീതികൾ ചില ജനിതക അപകടസാധ്യത വേരിയന്റുകളെ തിരിച്ചറിയാൻ ഉപയോഗിച്ചുവരുന്നു.[24] ജീനോം സ്കാനിംഗിലും കുടുംബ സ്വഭാവ പാരമ്പര്യ വിശകലനത്തിലും ശ്രദ്ധ കേന്ദ്രീകരിക്കുന്ന ഗവേഷണം, ടൈപ്പ് 1 പ്രമേഹം, റൂമറ്റോയ്ഡ് ആർത്രൈറ്റിസ് തുടങ്ങിയ ഓട്ടോഇമ്യൂൺ രോഗങ്ങളുടെ എറ്റിയോളജി കൂടുതൽ മനസ്സിലാക്കാൻ ശാസ്ത്രജ്ഞരെ പ്രാപ്തരാക്കുന്നു.[25]
- പാൻക്രിയാറ്റിക് β-കോശങ്ങളെ ശരീരത്തിലെ പ്രതിരോധ സംവിധാനം ലക്ഷ്യമാക്കി നശിപ്പിക്കുന്ന അവസ്ഥയാണ് ടൈപ്പ് 1 പ്രമേഹം.[26] പാൻക്രിയാസിലെ ഇൻസുലിൻ ഉത്പാദനത്തിന് മധ്യസ്ഥത വഹിക്കുന്ന ഇൻസുലിൻ ജീനിലേക്കുള്ള (ഐഎൻഎസ്) നിയോ-നാറ്റൽ മ്യൂട്ടേഷനുകളുടെ ഫലമായാണ് ഈ അവസ്ഥ ഉണ്ടാകുന്നത്.[26] ടൈറോസിൻ ഹൈഡ്രോ ക്സൈലേസിനും ഇൻസുലിൻ പോലുള്ള വളർച്ചാ ഘടകം II നും ഉള്ള ജീനുകൾക്കിടയിലുള്ള ക്രോമസോം 11p15.5 ന്റെ ചെറിയ കൈയിലാണ് INS ജീൻ സ്ഥിതി ചെയ്യുന്നത്.[27] ക്രോമസോം 11-ന് പുറമേ, ടൈപ്പ് 1 പ്രമേഹത്തിന്റെ ജനിതക നിർണ്ണയം ക്രോമസോം 6p21-ൽ സ്ഥിതി ചെയ്യുന്ന പ്രധാന ഹിസ്റ്റോകോംപാറ്റിബിലിറ്റി കോംപ്ലക്സ് (MHC) എന്നറിയപ്പെടുന്ന ഒരു ലോക്കസാണ്.[25]
- റൂമറ്റോയ്ഡ് ആർത്രൈറ്റിസ്: ഈ അവസ്ഥയ്ക്ക് പൂർണ്ണമായ ജനിതക മാപ്പിംഗ് ഇല്ലെങ്കിലും, നിരവധി ജീനുകൾ റൂമറ്റോയ്ഡ് ആർത്രൈറ്റിസ് ഉണ്ടാക്കുന്നതിൽ പങ്കുവഹിക്കുന്നതായി കരുതപ്പെടുന്നു. മനുഷ്യന്റെ രോഗപ്രതിരോധ സംവിധാനത്തെ സ്വാധീനിക്കുന്ന ജീനുകളിൽ TNF റിസപ്റ്ററുമായി ബന്ധപ്പെട്ട ഘടകം 1 (TRAF1) അടങ്ങിയിരിക്കുന്നു. ഈ TRAF1 സ്ഥിതി ചെയ്യുന്നത് 9q33-34 ക്രോമസോമിലാണ്.[28] കൂടാതെ, മനുഷ്യ ജീനോമിലെ B1 ജീനുകളിൽ RA രോഗികളിൽ സാധാരണയായി കാണപ്പെടുന്ന HLA-DRB1 അല്ലീലുകളുടെ വർദ്ധിച്ച സാന്ദ്രത അടങ്ങിയിരിക്കുന്നു. [29] ജീനോമിനുള്ളിലെ പോളിമോർഫിസങ്ങളുടെ അനന്തരഫലമായി RA യുടെ തീവ്രതയിൽ വ്യത്യാസമുണ്ടാകാം. [29]
പാരിസ്ഥിതിക ഘടകങ്ങൾ
[തിരുത്തുക]പാരിസ്ഥിതിക ഘടകങ്ങളുടെ ഒരു ശ്രേണി ഒന്നുകിൽ ചില ഓട്ടോഇമ്യൂൺ രോഗ വികസനത്തിൽ നേരിട്ടുള്ള പങ്ക് വഹിക്കുകയോ അല്ലെങ്കിൽ ചില ഓട്ടോഇമ്യൂൺ രോഗങ്ങൾക്ക് ഉത്തേജകമായി പ്രവർത്തിക്കുകയോ ചെയ്യുന്നു. രാസവസ്തുക്കൾ, അണുബാധ, ഭക്ഷണക്രമം, കുടൽ ഡിസ്ബയോസിസ് എന്നിവയുൾപ്പെടെയുള്ള പാരിസ്ഥിതിക ഘടകങ്ങൾ മൂലമാകാം ഓട്ടോഇമ്യൂൺ രോഗങ്ങളുടെ എഴുപത് ശതമാനം വരെ ഉണ്ടാകുന്നതെന്നാണ് നിലവിലെ പഠനങ്ങൾ സൂചിപ്പിക്കുന്നത്. ഒരു കൂട്ടം ഘട്ടങ്ങൾ ഓട്ടോഇമ്യൂൺ രോഗത്തിന്റെ സാധ്യതയ്ക്ക് തിരിച്ചറിഞ്ഞിട്ടുണ്ട്, എന്നിരുന്നാലും ഇതിന് ഇപ്പോഴും കൃത്യമായ തെളിവുകളൊന്നുമില്ല.[30]
- പാരിസ്ഥിതിക ട്രിഗറുകൾ
- ഓറൽ ടോളറൻസ് കുറവ്
- ഗട്ട് ഡിസ്ബയോസിസ്
- മെച്ചപ്പെട്ട ഗട്ട് പെർമിയബിലിറ്റി
- രോഗപ്രതിരോധ പ്രതിപ്രവർത്തന വർദ്ധന
- ഓട്ടോ ഇമ്മ്യൂണിറ്റി
രാസവസ്തുക്കൾ നേരിട്ടുള്ള പരിതസ്ഥിതിയിൽ അല്ലെങ്കിൽ മരുന്നുകളുടെ രൂപത്തിൽ ആവാം. ചില ഉദാഹരണങ്ങൾ: ഹൈഡ്രസീനുകൾ, ഹെയർ ഡൈകൾ, ട്രൈക്ലോറോഎത്തിലീൻ, ടാർട്രാസൈനുകൾ, അപകടകരമായ മാലിന്യങ്ങൾ, വ്യാവസായിക ഉദ്വമനം.[31]
അൾട്രാവയലറ്റ് വികിരണം ഓട്ടോഇമ്യൂൺ രോഗമായ ഡെർമറ്റോമയോസിറ്റിസിന്റെ വികാസത്തിന് കാരണമാകുമെന്ന് കണ്ടെത്തിയിട്ടുണ്ട്,[32] കീടനാശിനികളുടെ സമ്പർക്കം റൂമറ്റോയ്ഡ് ആർത്രൈറ്റിസ് വികസനത്തിൽ ഒരു പങ്ക് വഹിക്കുന്നു,[33] പ്രായമായവരിൽ രോഗപ്രതിരോധ ശേഷി കുറയുന്നത് തടയുന്നതിൽ വിറ്റാമിൻ ഡി ഒരു പ്രധാന ഘടകമാണെന്ന് കണ്ടെത്തിയിട്ടുണ്ട്.[34] ഓട്ടോഇമ്യൂൺ രോഗങ്ങൾ സജീവമാക്കുന്നതിന് ആവശ്യമായ ഒരു ഘട്ടമായ ടി സെൽ ആക്റ്റിവേറ്ററുകളായി സാംക്രമിക ഏജന്റുമാരെ കണക്കാക്കുന്നു. ഈ സംവിധാനങ്ങൾ താരതമ്യേന അജ്ഞാതമാണ്, എന്നാൽ ഗില്ലിൻ-ബാരെ സിൻഡ്രോം, റുമാറ്റിക് ഫീവർ തുടങ്ങിയ അണുബാധകൾ മൂലമുണ്ടാകുന്ന ഓട്ടോഇമ്യൂൺ രോഗങ്ങളെ വിശദീകരിക്കുന്നതിനുള്ള നിലവിലെ ബദൽ സിദ്ധാന്തങ്ങളിൽ ഒന്നാണ് ഇത്. [35]
പാത്തോഫിസിയോളജി
[തിരുത്തുക]ഒരു ഓട്ടോ ഇമ്യൂൺ രോഗാവസ്ഥ എങ്ങനെ ഉണ്ടാകുന്നു എന്നതിനെക്കുറിച്ച് നിരവധി വ്യത്യസ്ത സിദ്ധാന്തങ്ങളുണ്ട്. ചില പൊതുവായവ ചുവടെ പട്ടികപ്പെടുത്തിയിരിക്കുന്നു.
മനുഷ്യന്റെ രോഗപ്രതിരോധ വ്യവസ്ഥ സാധാരണയായി ടി സെല്ലുകളും ബി സെല്ലുകളും ഉത്പാദിപ്പിക്കുന്നു, അവ സെൽഫ് പ്രോട്ടീനുമായി പ്രതിപ്രവർത്തനം നടത്താൻ കഴിവുള്ളവയാണ്, എന്നാൽ ഈ സ്വയം പ്രതിപ്രവർത്തന കോശങ്ങൾ സാധാരണയായി ഒന്നുകിൽ രോഗപ്രതിരോധ സംവിധാനത്തിനുള്ളിൽ സജീവമാകുന്നതിന് മുമ്പ് നശിപ്പിക്കപ്പെടുന്നു, അല്ലെങ്കിൽ ഇത് ഒരു നിർജ്ജീവാവസ്ഥയിലേക്ക് മാറ്റപ്പെടുന്നു, അല്ലെങ്കിൽ റെഗുലേറ്ററി സെല്ലുകൾ വഴി രോഗപ്രതിരോധ സംവിധാനത്തിനുള്ളിലെ അവരുടെ റോളിൽ നിന്ന് നീക്കം ചെയ്യപ്പെടുന്നു. ഈ സംവിധാനങ്ങളിലൊന്ന് പരാജയപ്പെടുമ്പോൾ, രോഗപ്രതിരോധ സംവിധാനത്തിനുള്ളിൽ പ്രവർത്തനക്ഷമമാകുന്ന സ്വയം പ്രതിപ്രവർത്തന കോശങ്ങളുടെ ഒരു റിസർവോയർ സാധ്യമാണ്. ടി സെൽ പ്രായപൂർത്തിയായ ഒരു രോഗപ്രതിരോധ കോശമായി വികസിക്കുന്നതിനാൽ, തൈമസിനുള്ളിലെ നെഗറ്റീവ് സെലക്ഷൻ പ്രക്രിയയിലൂടെ സ്വയം-പ്രതിക്രിയാത്മക ടി കോശങ്ങൾ സൃഷ്ടിക്കുന്നത് തടയുന്നതിനുള്ള സംവിധാനങ്ങൾ നടക്കുന്നു.
Campylobacter jejuni പോലുള്ള ചില അണുബാധകൾക്ക് നമ്മുടെ സ്വന്തം തന്മാത്രകൾക്ക് സമാനമായ ആന്റിജനുകൾ ഉണ്ട്. ഈ സാഹചര്യത്തിൽ, C. jejuni-നുള്ള ഒരു സാധാരണ രോഗപ്രതിരോധ പ്രതികരണം, പെരിഫറൽ ഞരമ്പുകളുടെ ആക്സോണുകൾക്ക് ചുറ്റുമുള്ള മൈലിൻ ആവരണത്തിന്റെ ഗാംഗ്ലിയോസൈഡുകളുമായി (അതായത്, Guillain-Barré ) കുറഞ്ഞ അളവിൽ പ്രതികരിക്കുന്ന ആന്റിബോഡികളുടെ ഉത്പാദനത്തിന് കാരണമാകും. ഓട്ടോ ഇമ്മ്യൂൺ രോഗങ്ങളുടെ അന്തർലീനമായ പാത്തോഫിസിയോളജിയെക്കുറിച്ചുള്ള ഒരു പ്രധാന ധാരണ, ഓട്ടോ ഇമ്യൂൺ രോഗങ്ങൾക്കിടയിൽ ജനിതക പങ്കിടലിന്റെ ഒരു പരിധിവരെ തിരിച്ചറിഞ്ഞ ജീനോം-വൈഡ് അസോസിയേഷൻ സ്കാനുകളുടെ പ്രയോഗമാണ്.[36]
മറുവശത്ത്, സ്വയം-പ്രതികരണാത്മകമായ രോഗപ്രതിരോധ പ്രതികരണത്തിന്റെ (ഉദാഹരണത്തിന്, ഓട്ടോ-ആന്റിബോഡികൾ, സ്വയം-റിയാക്ടീവ് ടി സെല്ലുകൾ), കേടുപാടുകളോ അല്ലാതെയോ അല്ലെങ്കിൽ അതിന്റെ ഫലമായുണ്ടാകുന്ന പാത്തോളജിയോ ആണ് ഓട്ടോ ഇമ്യൂണിറ്റി.[37] ഇക്കാരണത്താൽ, ഓട്ടോആൻറിബോഡികൾ മിക്ക സ്വയം രോഗപ്രതിരോധ വൈകല്യങ്ങളുടെയും മുഖമുദ്രയാണ്. [38] ഇത് ചില അവയവങ്ങളിൽ മാത്രമായി പരിമിതപ്പെടുത്തിയേക്കാം (ഉദാ: ഓട്ടോ ഇമ്മ്യൂൺ തൈറോയ്ഡൈറ്റിസ്) അല്ലെങ്കിൽ വിവിധ സ്ഥലങ്ങളിൽ ഒരു പ്രത്യേക ടിഷ്യു കളെ ബാധിക്കുന്നു (ഉദാ. ശ്വാസകോശത്തിലെയും വൃക്കയിലെയും ബേസ്മെൻറ് മെംബ്രണിനെ ബാധിച്ചേക്കാവുന്ന ഗുഡ്പാസ്ചർ രോഗം).
രോഗനിർണയം
[തിരുത്തുക]ഒരു രോഗത്തെ ഒരു ഓട്ടോഇമ്മ്യൂൺ രോഗമായി കണക്കാക്കണമെങ്കിൽ അത് ആദ്യം 1957-ൽ ഏണസ്റ്റ് വൈറ്റെബ്സ്കിയും സഹപ്രവർത്തകരും ചേർന്ന് രൂപപ്പെടുത്തിയതും 1994-ൽ പരിഷ്ക്കരിച്ചതും ആയ വൈറ്റെബ്സ്കിയുടെ പോസ്റ്റുലേറ്റുകൾക്ക് ഉത്തരം നൽകേണ്ടതുണ്ട്:[39][40]
- രോഗം ഉണ്ടാക്കുന്ന ആന്റിബോഡി അല്ലെങ്കിൽ രോഗം ഉണ്ടാക്കുന്ന ടി ലിംഫോസൈറ്റ് വെളുത്ത രക്താണുക്കളുടെ കൈമാറ്റത്തിൽ നിന്നുള്ള നേരിട്ടുള്ള തെളിവുകൾ
- പരീക്ഷണാത്മക മൃഗങ്ങളിൽ ഓട്ടോഇമ്മ്യൂൺ രോഗത്തിന്റെ പുനരുൽപാദനത്തെ അടിസ്ഥാനമാക്കിയുള്ള പരോക്ഷ തെളിവുകൾ
- ക്ലിനിക്കൽ സൂചനകളിൽ നിന്നുള്ള സാഹചര്യ തെളിവുകൾ
ആദ്യകാല ഓട്ടോഇമ്മ്യൂൺ രോഗത്തിൻറെ ലക്ഷണങ്ങൾ പലപ്പോഴും സാധാരണ അസുഖങ്ങൾ പോലെയാണ്: ക്ഷീണം, പനി, അസ്വാസ്ഥ്യം, സന്ധി വേദന, ചുണങ്ങു തുടങ്ങിയവ. രോഗം ബാധിച്ച സ്ഥലം, രോഗം ഉണ്ടാക്കുന്ന ഏജന്റുകൾ, വ്യക്തികൾ എന്നിവയിൽ ലക്ഷണങ്ങൾ വ്യത്യാസപ്പെട്ടിരിക്കുന്നതിനാൽ, ശരിയായ രോഗനിർണയം ബുദ്ധിമുട്ടായിരുന്നു. സാധാരണഗതിയിൽ, രോഗനിർണയം ആരംഭിക്കുന്നത് ഒരു രോഗിയുടെ കുടുംബ ചരിത്രം പരിശോധിക്കുന്നതിലൂടെയാണ്. പിന്നീട് മറ്റ് വിവിധ പരിശോധനകള് നടത്തുന്നു, കാരണം ഒരൊറ്റ പരിശോധനയ്ക്കും ഓട്ടോഇമ്മ്യൂൺ രോഗത്തെ തിരിച്ചറിയാൻ കഴിയില്ല. [31]
ആന്റി ന്യൂക്ലിയർ ആന്റിബോഡി
[തിരുത്തുക]ശരീരം സ്വന്തം കോശങ്ങളെ ആക്രമിക്കുമ്പോൾ ഉത്പാദിപ്പിക്കുന്ന ആന്റി ന്യൂക്ലിയർ ആന്റിബോഡികൾ എന്നറിയപ്പെടുന്ന അസാധാരണ പ്രോട്ടീനുകളെ തിരിച്ചറിയാൻ ഉപയോഗിക്കുന്ന ഒരു പരിശോധന. [31] പല വൈകല്യങ്ങളിലും ഇത് പോസിറ്റീവ് ആയി കാണിച്ചേക്കാം. 95% പോസിറ്റീവ് ടെസ്റ്റ് റേറ്റ് ഉള്ള സിസ്റ്റമിക് ല്യൂപ്പസ് എറിത്തമറ്റോസസ് നിർണ്ണയിക്കാൻ ഈ ടെസ്റ്റ് ഏറ്റവും ഉപയോഗപ്രദമാണ്. [41]
കംപ്ളീറ്റ് ബ്ലഡ് കൌണ്ട്
[തിരുത്തുക]രക്തകോശങ്ങളുടെ മെച്യൂരിറ്റി ലെവലുകൾ, എണ്ണം, വലിപ്പം എന്നി അളവുകൾ എടുക്കുന്ന ഒരു രക്ത പരിശോധന.[31] ടാർഗെറ്റഡ് സെല്ലുകൾ ചുവന്ന രക്താണുക്കൾ, വെളുത്ത രക്താണുക്കൾ, ഹീമോഗ്ലോബിൻ, ഹെമറ്റോക്രിറ്റ്, പ്ലേറ്റ്ലെറ്റുകൾ എന്നിവയാണ്. ഇവയുടെ എണ്ണത്തിലെ വർദ്ധനവോ കുറവോ അടിസ്ഥാനമാക്കി, അടിസ്ഥാനപരമായ രോഗാവസ്ഥകൾ കൂടി കണക്കിലെടുത്ത് രോഗനിർണയം നടത്താം. സാധാരണഗതിയിൽ, ഓട്ടോഇമ്മ്യൂൺ രോഗത്തിൽ വെളുത്ത രക്താണുക്കളുടെ എണ്ണം കുറഞ്ഞ (ല്യൂക്കോപീനിയ) കാണപ്പെടാം. ശരിയായ രോഗനിർണയത്തിനായി, കൂടുതൽ പരിശോധനകൾ ആവശ്യമാണ്. [42]
കോബ്ലിമെന്റ്
[തിരുത്തുക]രക്തത്തിനുള്ളിലെ കോബ്ലിമെന്റ് എന്ന് വിളിക്കപ്പെടുന്ന രോഗപ്രതിരോധ വ്യവസ്ഥയുടെ ഒരു പ്രോട്ടീൻ ഗ്രൂപ്പിന്റെ അളവ് അളക്കാൻ ഉപയോഗിക്കുന്ന ഒരു പരിശോധന. കോബ്ലിമെന്റ് കുറഞ്ഞ അളവിൽ ആയാൽ അത് രോഗത്തിന്റെ സൂചനയായിരിക്കാം. [31]
സി-റിയാക്ടീവ് പ്രോട്ടീൻ
[തിരുത്തുക]കരളിൽ നിർമ്മിക്കുന്ന ഒരു പ്രോട്ടീൻ ആയ സി-റിയാക്ടീവ് പ്രോട്ടീൻ സാധാരണയായി വീക്കം കൂടുന്നതിനനുസരിച്ച് വർദ്ധിക്കുന്നു. ഓട്ടോ ഇമ്മ്യൂൺ രോഗങ്ങളിൽ ഇത് കൂടുതലായിരിക്കാം. [31]
എറിത്രോസൈറ്റ് സെഡിമെന്റേഷൻ നിരക്ക്
[തിരുത്തുക]ഈ പരിശോധന ഒരു ടെസ്റ്റ് ട്യൂബിൽ ഒരു രോഗിയുടെ രക്തകോശങ്ങൾ അടിയുന്നതിന്റെ നിരക്ക് അളക്കുന്നു. കൂടുതൽ വേഗത്തിൽ കോശങ്ങൾ അടിയുന്നത് ഓട്ടോഇമ്മ്യൂൺ രോഗത്തിന്റെ ഒരു സാധാരണ ലക്ഷണമായ വീക്കം സൂചിപ്പിക്കാം. [31]
ഈ പരിശോധനകൾ സൂചിപ്പിക്കുന്നത് ആന്റിബോഡി അസാധാരണത്വങ്ങളും വീക്കവുമാണ്. നിലവിലുള്ള ഓട്ടോഇമ്മ്യൂൺ രോഗത്തെ തിരിച്ചറിയാൻ കൂടുതൽ പരിശോധനകൾ ആവശ്യമാണ്ൻ . [31]
ചികിത്സ
[തിരുത്തുക]ചികിത്സ രോഗത്തിന്റെ തരത്തെയും തീവ്രതയെയും ആശ്രയിച്ചിരിക്കുന്നു. ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങളിൽ ഭൂരിഭാഗവും വിട്ടുമാറാത്തവയാണ്, അവയ്ക്ക് കൃത്യമായ ചികിത്സയില്ല, എന്നാൽ ചികിത്സയിലൂടെ രോഗലക്ഷണങ്ങൾ ലഘൂകരിക്കാനും നിയന്ത്രിക്കാനും കഴിയും. സാധാരണ ചികിത്സാ രീതികളിൽ ഇവ ഉൾപ്പെടുന്നു: [11]
- രോഗം കാരണം ശരീരത്തിന് എന്താണ് കുറവുള്ളത് എന്നതിന് അനുസരിച്ച് വിറ്റാമിൻ അല്ലെങ്കിൽ ഹോർമോൺ സപ്ലിമെന്റുകൾ (ഇൻസുലിൻ, വിറ്റാമിൻ ബി 12, തൈറോയ്ഡ് ഹോർമോൺ മുതലായവ. )
- രോഗം രക്തവുമായി ബന്ധപ്പെട്ടതാണെങ്കിൽ രക്തപ്പകർച്ച
- രോഗം അസ്ഥികളെയോ സന്ധികളെയോ പേശികളെയോ ബാധിക്കുകയാണെങ്കിൽ ഫിസിക്കൽ തെറാപ്പി
പരമ്പരാഗത ചികിത്സാ ഓപ്ഷനുകളിൽ ശരീരത്തിന്റെ സ്വന്തം ടിഷ്യൂകൾക്കെതിരായ പ്രതിരോധ പ്രതികരണം കുറയ്ക്കുന്നതിനുള്ള രോഗപ്രതിരോധ മരുന്നുകൾ ഉൾപ്പെടുന്നു. ഉദാഹരണങ്ങൾ: [43]
- വീക്കം കുറയ്ക്കാൻ നോൺ-സ്റ്റിറോയിഡൽ ആന്റി-ഇൻഫ്ലമേറ്ററി മരുന്നുകൾ (NSAIDs).
- വീക്കം കുറയ്ക്കാൻ ഗ്ലൂക്കോകോർട്ടിക്കോയിഡുകൾ
- ഇൻഫ്ലമേറ്ററി ഓട്ടോ ഇമ്മ്യൂൺ പ്രതികരണത്തിന്റെ കേടുപാടുകൾ വരുത്തുന്ന ടിഷ്യൂകളെയും അവയവങ്ങളെയും കുറയ്ക്കുന്നതിന് ഡിസീസ്-മോഡിഫൈയിങ് ആന്റി-റുമാറ്റിക് മരുന്നുകൾ (DMARDs).
രോഗപ്രതിരോധ മരുന്നുകൾ മൊത്തത്തിലുള്ള രോഗപ്രതിരോധ പ്രതികരണത്തെ ദുർബലപ്പെടുത്തുന്നതിനാൽ, രോഗലക്ഷണങ്ങളുടെ ആശ്വാസം രോഗിയുടെ ജീവിതത്തിന് അപകടകരമായേക്കാവുന്ന അണുബാധകളെ ചെറുക്കാനുള്ള കഴിവ് കുറയ്ക്കുന്നത് കൂടി പരിഗണിച്ച് സന്തുലിതമാക്കണം. [44]
പാരമ്പര്യേതര ചികിത്സകൾ ഗവേഷണം ചെയ്യുകയും വികസിപ്പിക്കുകയും ഉപയോഗിക്കുകയും ചെയ്തു വരുന്നുണ്ട് പ്രത്യേകിച്ചും പരമ്പരാഗത ചികിത്സകൾ പരാജയപ്പെടുമ്പോൾ. ഈ രീതികൾ ഒന്നുകിൽ ശരീരത്തിലെ രോഗകാരി കോശങ്ങൾ സജീവമാക്കുന്നത് തടയുക, അല്ലെങ്കിൽ ഈ കോശങ്ങളെ സ്വാഭാവികമായി അടിച്ചമർത്തുന്ന പാതയിൽ മാറ്റം വരുത്തുക എന്നതാണ് ചെയ്യുന്നത്. [44] [45] ഈ ചികിത്സകൾ രോഗിക്ക് വിഷാംശം കുറയ്ക്കുകയും കൂടുതൽ നിർദ്ദിഷ്ട ലക്ഷ്യങ്ങൾ നൽകുകയും ചെയ്യുന്നു. [45] അത്തരം ഓപ്ഷനുകളിൽ ഇവ ഉൾപ്പെടുന്നു:
- പ്രോ-ഇൻഫ്ലമേറ്ററി സൈറ്റോകൈനുകളെ തടയാൻ ഉപയോഗിക്കാവുന്ന മോണോക്ലോണൽ ആന്റിബോഡികൾ
- ഓട്ടോ ഇമ്മ്യൂൺ രോഗത്തിന് കാരണമാകുന്ന അസാധാരണ കോശങ്ങളെ പ്രത്യേകമായി ലക്ഷ്യം വയ്ക്കാൻ രോഗപ്രതിരോധ കോശങ്ങളെ അനുവദിക്കുന്ന ആന്റിജൻ-നിർദ്ദിഷ്ട ഇമ്മ്യൂണോതെറാപ്പി [45]
- ഓട്ടോ ഇമ്മ്യൂൺ പ്രതികരണത്തിലേക്ക് നയിക്കുന്ന പാത തടയാൻ പ്രവർത്തിക്കുന്ന കോ-സ്റ്റിമുലേറ്ററി ബ്ലോക്ക്
- ഓട്ടോ ഇമ്മ്യൂൺ പ്രതികരണത്തെ അടിച്ചമർത്താൻ ഈ പ്രത്യേക തരം ടി സെൽ ഉപയോഗിക്കുന്ന റെഗുലേറ്ററി ടി സെൽ തെറാപ്പി [44]
ഗവേഷണം
[തിരുത്തുക]ഓട്ടോ ഇമ്മ്യൂൺ, കോശജ്വലന രോഗങ്ങളിൽ, മനുഷ്യന്റെ അഡാപ്റ്റീവ് അല്ലെങ്കിൽ സഹജമായ രോഗപ്രതിരോധ സംവിധാനങ്ങളുടെ വ്യതിചലന പ്രതികരണങ്ങളിലൂടെയാണ് ഈ അവസ്ഥ ഉണ്ടാകുന്നത്. ഓട്ടോ ഇമ്മ്യൂൺരോഗങ്ങളിൽ, ശരീരത്തിന്റെ സ്വന്തം പ്രോട്ടീനുകൾക്കെതിരെ രോഗിയുടെ പ്രതിരോധ സംവിധാനം സജീവമാകുന്നു. വിട്ടുമാറാത്ത കോശജ്വലന രോഗങ്ങളിൽ, ന്യൂട്രോഫിലുകളും മറ്റ് ല്യൂക്കോസൈറ്റുകളും സൈറ്റോകൈനുകളും കീമോകൈനുകളും ഉപയോഗിച്ച് ഘടനാപരമായി റിക്രൂട്ട് ചെയ്യപ്പെടുന്നു, ഇത് ടിഷ്യു നാശത്തിന് കാരണമാകുന്നു.
ആൻറി-ഇൻഫ്ലമേറ്ററി ജീനുകൾ സജീവമാക്കുന്നതിലൂടെയും രോഗപ്രതിരോധ കോശങ്ങളിലെ കോശജ്വലന ജീനുകളെ അടിച്ചമർത്തുന്നതിലൂടെയും വീക്കം ലഘൂകരിക്കുന്നത് ഒരു നല്ല ചികിത്സാ സമീപനമാണ്. [46] [47] [48] ഓട്ടോആന്റിബോഡികളുടെ ഉത്പാദനം ആരംഭിച്ചുകഴിഞ്ഞാൽ, ഓട്ടോആൻറിബോഡികൾക്ക് സ്വന്തം ഉൽപ്പാദനം നിലനിർത്താനുള്ള ശേഷിയുണ്ടെന്നതിന് ഒരു തെളിവുണ്ട്. [49]
സ്റ്റെം സെൽ തെറാപ്പി
[തിരുത്തുക]സ്റ്റെം സെൽ ട്രാൻസ്പ്ലാൻറേഷൻ പഠിച്ചുകൊണ്ടിരിക്കുകയാണ്, ചില കേസുകളിൽ ഇത് ചില നല്ല ഫലങ്ങൾ കാണിക്കുകയും ചെയ്തിട്ടുണ്ട്. [50]
ടൈപ്പ് 1 പ്രമേഹത്തിൽ നശിപ്പിക്കപ്പെടുന്ന പാൻക്രിയാറ്റിക് β കോശങ്ങൾ മാറ്റിസ്ഥാപിക്കുന്നതിനുള്ള മെഡിക്കൽ പരീക്ഷണങ്ങൾ പുരോഗമിക്കുകയാണ്. [51]
ആൾട്ടേഡ് ഗ്ലൈക്കൻ സിദ്ധാന്തം
[തിരുത്തുക]ഈ സിദ്ധാന്തമനുസരിച്ച്, രോഗപ്രതിരോധ സംവിധാനത്തിന്റെ കോശങ്ങളും ഹ്യൂമറൽ ഘടകങ്ങളും പ്രദർശിപ്പിക്കുന്ന ഗ്ലൈക്കനുകൾ (പോളിസാക്രറൈഡുകൾ) രോഗപ്രതിരോധ പ്രതികരണത്തിന്റെ ഫലപ്രാപ്തി പ്രവർത്തനം മധ്യസ്ഥമാക്കുന്നു. ഓട്ടോ ഇമ്മ്യൂൺ ശേഷിയുള്ള വ്യക്തികൾക്ക് അവരുടെ ഗ്ലൈക്കോസൈലേഷൻ പ്രൊഫൈലിൽ മാറ്റങ്ങളുണ്ട്, അങ്ങനെ ഒരു പ്രോ-ഇൻഫ്ലമേറ്ററി രോഗപ്രതിരോധ പ്രതികരണം അനുകൂലമാണ്. വ്യക്തിഗത ഓട്ടോ ഇമ്മ്യൂൺ രോഗങ്ങൾക്ക് സവിശേഷമായ ഗ്ലൈക്കൻ ഒപ്പുകൾ ഉണ്ടായിരിക്കുമെന്ന് കൂടുതൽ അനുമാനിക്കപ്പെടുന്നു. [52]
ശുചിത്വ സിദ്ധാന്തം
[തിരുത്തുക]ശുചിത്വ സിദ്ധാന്തമനുസരിച്ച്, ഉയർന്ന അളവിലുള്ള ശുചിത്വം മുൻകാലങ്ങളെ അപേക്ഷിച്ച് കുറച്ച് ആന്റിജനുകളിലേക്ക് കുട്ടികളെ തുറന്നുകാട്ടുന്നു, ഇത് അവരുടെ രോഗപ്രതിരോധ സംവിധാനങ്ങൾ അമിതമായി പ്രവർത്തിക്കുകയും സ്വന്തം ടിഷ്യുകളെ വിദേശികളാണെന്ന് തെറ്റിദ്ധരിപ്പിക്കുകയും ചെയ്യുന്നു, ഇത് ഓട്ടോഇമ്മ്യൂൺ അല്ലെങ്കിൽ ആസ്ത്മ പോലുള്ള അലർജി അവസ്ഥകൾക്ക് കാരണമാകുന്നു. [53]
രോഗപ്രതിരോധ പ്രതികരണത്തിൽ വിറ്റാമിൻ ഡി യുടെ സ്വാധീനം
[തിരുത്തുക]അഡാപ്റ്റീവ് ആയതും, സഹജമായതും ആയ രോഗപ്രതിരോധ പ്രതികരണത്തെ സഹായിക്കുന്ന ഒരു ഇമ്മ്യൂൺ റെഗുലേറ്റർ എന്നാണ് വിറ്റാമിൻ ഡി അറിയപ്പെടുന്നത്. [54] [55] പാരമ്പര്യമോ പാരിസ്ഥിതികമോ ആയ കാരണങ്ങളാലുള്ള വൈറ്റമിൻ ഡിയുടെ കുറവ്, കൂടുതൽ കാര്യക്ഷമമല്ലാത്തതും ദുർബലവുമായ രോഗപ്രതിരോധ പ്രതികരണത്തിലേക്ക് നയിക്കുകയും ഓട്ടോഇമ്മ്യൂൺ രോഗങ്ങളുടെ വികാസത്തിന് കാരണമാകുകയും ചെയ്യും. [55] വിറ്റാമിൻ ഡി ഉള്ളതിനാൽ, വിറ്റാമിൻ ഡി റെസ്പോൺസ് ഏലമെന്റ് (വിഡിആർഇ) എൻകോഡ് ചെയ്യുകയും പാറ്റേൺ റെക്കഗ്നിഷൻ റിസപ്റ്റർ (പിആർആർ) പ്രതികരണങ്ങളും ആ പ്രതികരണങ്ങളുമായി ബന്ധപ്പെട്ട ജീനുകളും വഴി പ്രകടിപ്പിക്കുകയും ചെയ്യുന്നു. [54] പ്രകടിപ്പിക്കുന്ന നിർദ്ദിഷ്ട ഡിഎൻഎ ടാർഗെറ്റ് സീക്വൻസ് 1,25-(OH)2D3 എന്നറിയപ്പെടുന്നു. [54] 1,25-(OH)2D3 ന്റെ എക്സ്പ്രഷൻ മാക്രോഫേജുകൾ, ഡെൻഡ്രിറ്റിക് സെല്ലുകൾ, ടി-സെല്ലുകൾ, ബി-സെല്ലുകൾ എന്നിവയാൽ പ്രചോദിപ്പിക്കപ്പെടാം. [54] 1,25-(OH)2D3 ന്റെ സാന്നിധ്യത്തിൽ, രോഗപ്രതിരോധ സംവിധാനത്തിന്റെ ഇൻഫ്ലമേറ്ററി സൈറ്റോകൈനുകളുടെ ഉത്പാദനം അടിച്ചമർത്തപ്പെടുകയും കൂടുതൽ ടോളറോജെനിക് റെഗുലേറ്ററി ടി-സെല്ലുകൾ എക്സ്പ്രസ് ചെയ്യുകയും ചെയ്യുന്നു. [54] സെൽ പക്വതയിൽ വിറ്റാമിൻ ഡിയുടെ സ്വാധീനം, പ്രത്യേകിച്ച് ടി-കോശങ്ങൾ, അവയുടെ ഫിനോടൈപ്പ് എക്സ്പ്രഷൻ എന്നിവയാണ് ഇതിന് കാരണം. [54] 1,25-(OH)2D3 എക്സ്പ്രഷന്റെ അഭാവം, ടോളറൻസ് കുറഞ്ഞ ടി-സെല്ലുകളിലേക്കുള്ള ആന്റിജനുകളുടെ വലിയ അവതരണത്തിലേക്കും, ഇൻഫ്ലമേറ്ററി പ്രതികരണം വർദ്ധിപ്പിക്കുന്നതിലേക്കും നയിച്ചേക്കാം. [54]
ഇതും കാണുക
[തിരുത്തുക]അവലംബം
[തിരുത്തുക]- ↑ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 1.12 1.13 1.14 1.15 1.16 1.17 "Autoimmune diseases fact sheet". U.S. Department of Health and Human Services. 16 July 2012. Archived from the original on 5 October 2016. Retrieved 5 October 2016.
- ↑ 2.0 2.1 "Update on intravenous immunoglobulins (IVIg) mechanisms of action and off- label use in autoimmune diseases". Current Pharmaceutical Design. 17 (29): 3166–75. 2011. doi:10.2174/138161211798157540. PMID 21864262.
- ↑ 3.0 3.1 3.2 3.3 3.4 Borgelt, Laura Marie (2010). Women's Health Across the Lifespan: A Pharmacotherapeutic Approach (in ഇംഗ്ലീഷ്). ASHP. p. 579. ISBN 978-1-58528-194-7. Archived from the original on 2017-09-08.
- ↑ "List of Autoimmune Diseases". Autoimmune Registry Inc. (in അമേരിക്കൻ ഇംഗ്ലീഷ്). Retrieved 2022-06-06.
- ↑ Angum, Fariha; Khan, Tahir; Kaler, Jasndeep; Siddiqui, Lena; Hussain, Azhar (2020-05-13). "The Prevalence of Autoimmune Disorders in Women: A Narrative Review". Cureus (in ഇംഗ്ലീഷ്). 12 (5): e8094. doi:10.7759/cureus.8094. ISSN 2168-8184. PMC 7292717. PMID 32542149.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ↑ www.nationalacademies.org https://www.nationalacademies.org/our-work/assessment-of-nih-research-on-autoimmune-diseases. Retrieved 2022-06-13.
{{cite web}}: Missing or empty|title=(help) - ↑ 7.0 7.1 "The search for the target antigens of multiple sclerosis, part 1: autoreactive CD4+ T lymphocytes as pathogenic effectors and therapeutic targets". The Lancet Neurology. 15 (2): 198–209. February 2016. doi:10.1016/S1474-4422(15)00334-8. PMID 26724103.
- ↑ Ananthanarayan R, Paniker CK (2005). Ananthanarayan and Paniker's Textbook of Microbiology (in ഇംഗ്ലീഷ്). Orient Blackswan. p. 169. ISBN 9788125028086. Archived from the original on 2017-09-08.
- ↑ Watson, Stephanie (March 26, 2019). "Autoimmune Diseases: Types, Symptoms, Causes and More". Healthline. Retrieved November 11, 2020.
- ↑ "Introduction to immunology and autoimmunity". Environmental Health Perspectives. 107 Suppl 5 (suppl 5): 661–5. October 1999. doi:10.1289/ehp.99107s5661. PMC 1566249. PMID 10502528.
- ↑ 11.0 11.1 "Autoimmune disorders". MedlinePlus, US National Library of Medicine. 16 July 2013. Retrieved 12 July 2023.
- ↑ National Research Council (US) Subcommittee on Immunotoxicology (1992). Autoimmune Diseases (in ഇംഗ്ലീഷ്). National Academies Press (US).
- ↑ "Human autoimmune diseases: a comprehensive update". Journal of Internal Medicine. 278 (4): 369–95. October 2015. doi:10.1111/joim.12395. PMID 26212387.
- ↑ 14.00 14.01 14.02 14.03 14.04 14.05 14.06 14.07 14.08 14.09 14.10 14.11 14.12 14.13 14.14 14.15 14.16 14.17 14.18 14.19 "Multiple associations between a broad spectrum of autoimmune diseases, chronic inflammatory diseases and cancer". Anticancer Research. 32 (4): 1119–36. April 2012. PMC 3349285. PMID 22493341.
- ↑ "Celiac disease: from oral tolerance to intestinal inflammation, autoimmunity and lymphomagenesis". Mucosal Immunology. 2 (1): 8–23. January 2009. doi:10.1038/mi.2008.75. PMID 19079330.
- ↑ "Risk of malignancy in patients with celiac disease". The American Journal of Medicine. 115 (3): 191–5. August 2003. doi:10.1016/s0002-9343(03)00302-4. PMID 12935825.
- ↑ "Papillary cancer of thyroid in celiac disease". Journal of Clinical Gastroenterology. 45 (5): e44-6. 2011. doi:10.1097/mcg.0b013e3181ea11cb. PMID 20697293.
- ↑ "Association of celiac disease and intestinal lymphomas and other cancers". Gastroenterology. 128 (4 Suppl 1): S79-86. April 2005. doi:10.1053/j.gastro.2005.02.027. PMID 15825131.
- ↑ "Multiple sclerosis--the plaque and its pathogenesis". The New England Journal of Medicine. 354 (9): 942–55. March 2006. doi:10.1056/nejmra052130. PMID 16510748.
- ↑ Turesson, Carl; Matteson, Eric L. (2009). "Clinical Features of Rheumatoid Arthritis: Extra-Articular Manifestations". Rheumatoid Arthritis. Elsevier. pp. 62–67. doi:10.1016/b978-032305475-1.50014-8. ISBN 978-0-323-05475-1.
- ↑ "Clinical aspects of rheumatoid arthritis". Pathophysiology. 12 (3): 153–65. October 2005. doi:10.1016/j.pathophys.2005.07.009. PMID 16125918.
- ↑ "Systemic lupus erythematosus". The New England Journal of Medicine. 365 (22): 2110–21. December 2011. doi:10.1056/nejmra1100359. PMID 22129255.
- ↑ "Autoimmune Disease List • AARDA". AARDA (in അമേരിക്കൻ ഇംഗ്ലീഷ്). 2016-06-01. Retrieved 2019-03-21.
- ↑ "Recent advances in the genetics of autoimmune disease". Annual Review of Immunology. 27: 363–91. 2009. doi:10.1146/annurev.immunol.021908.132653. PMC 2992886. PMID 19302045.
- ↑ 25.0 25.1 "Recent acquisitions on the genetic basis of autoimmune disease". Frontiers in Bioscience: A Journal and Virtual Library. 13 (13): 4838–51. May 2008. doi:10.2741/3043. PMID 18508549.
- ↑ 26.0 26.1 "Mutations in the insulin gene can cause MODY and autoantibody-negative type 1 diabetes". Diabetes. 57 (4): 1131–5. April 2008. doi:10.2337/db07-1467. PMID 18192540.
{{cite journal}}: Invalid|display-authors=6(help) - ↑ "Human type 1 diabetes and the insulin gene: principles of mapping polygenes". Annual Review of Genetics. 30: 343–70. 1996. doi:10.1146/annurev.genet.30.1.343. PMID 8982458.
- ↑ "A candidate gene approach identifies the TRAF1/C5 region as a risk factor for rheumatoid arthritis". PLOS Medicine. 4 (9): e278. September 2007. doi:10.1371/journal.pmed.0040278. PMC 1976626. PMID 17880261.
{{cite journal}}: Invalid|display-authors=6(help)CS1 maint: unflagged free DOI (link) - ↑ 29.0 29.1 "Correlation between disease phenotype and genetic heterogeneity in rheumatoid arthritis". The Journal of Clinical Investigation. 95 (5): 2120–6. May 1995. doi:10.1172/JCI117900. PMC 295811. PMID 7738179.
- ↑ "A Potential Link between Environmental Triggers and Autoimmunity". Autoimmune Diseases. 2014: 437231. 2014. doi:10.1155/2014/437231. PMC 3945069. PMID 24688790.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ↑ 31.0 31.1 31.2 31.3 31.4 31.5 31.6 31.7 "Autoimmune Diseases: Symptoms & Causes". Boston Children's Hospital. Archived from the original on 7 April 2021. Retrieved 23 March 2020.
- ↑ "Brief report: ultraviolet radiation exposure is associated with clinical and autoantibody phenotypes in juvenile myositis". Arthritis and Rheumatism. 65 (7): 1934–41. July 2013. doi:10.1002/art.37985. PMC 3727975. PMID 23658122.
- ↑ "Pesticide Exposure and Risk of Rheumatoid Arthritis among Licensed Male Pesticide Applicators in the Agricultural Health Study". Environmental Health Perspectives. 125 (7): 077010. July 2017. doi:10.1289/EHP1013. PMC 5744649. PMID 28718769.
- ↑ "Association between Vitamin D Deficiency and Antinuclear Antibodies in Middle-Aged and Older U.S. Adults". Cancer Epidemiology, Biomarkers & Prevention. 25 (12): 1559–1563. December 2016. doi:10.1158/1055-9965.EPI-16-0339. PMC 5135624. PMID 27543618.
- ↑ "Mechanisms for the induction of autoimmunity by infectious agents". The Journal of Clinical Investigation. 108 (8): 1097–104. October 2001. doi:10.1172/JCI14235. PMC 209539. PMID 11602615.
- ↑ "Immune-mediated disease genetics: the shared basis of pathogenesis". Trends in Immunology. 34 (1): 22–6. January 2013. doi:10.1016/j.it.2012.09.001. PMID 23031829.
- ↑ Harrison's Principles of Internal Medicine (in ഇംഗ്ലീഷ്). Vol. 1–2 (18th ed.). McGraw-Hill Professional. 2011-08-11. ISBN 978-0-07-174889-6.
- ↑ Chang, Sarah Esther; Feng, Allan; Meng, Wenzhao; Apostolidis, Sokratis A.; Mack, Elisabeth; Artandi, Maja; Barman, Linda; Bennett, Kate; Chakraborty, Saborni (December 2021). "New-onset IgG autoantibodies in hospitalized patients with COVID-19". Nature Communications. 12 (1): 5417. Bibcode:2021NatCo..12.5417C. doi:10.1038/s41467-021-25509-3. PMC 8440763. PMID 34521836.
- ↑ "Chronic thyroiditis and autoimmunization". Journal of the American Medical Association. 164 (13): 1439–47. July 1957. doi:10.1001/jama.1957.02980130015004. PMID 13448890.
- ↑ "Defining criteria for autoimmune diseases (Witebsky's postulates revisited)". Immunology Today. 14 (9): 426–30. September 1993. doi:10.1016/0167-5699(93)90244-F. PMID 8216719.
- ↑ "Antinuclear Antibody (ANA)". labtestsonline.org. Retrieved 14 April 2020.
- ↑ "Complete blood count (CBC)". www.mayoclinic.org. 19 December 2018. Retrieved 14 April 2020.
- ↑ "Drugs for Autoimmune Inflammatory Diseases: From Small Molecule Compounds to Anti-TNF Biologics". Frontiers in Pharmacology (in ഇംഗ്ലീഷ്). 8: 460. 2017. doi:10.3389/fphar.2017.00460. PMC 5506195. PMID 28785220.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ↑ 44.0 44.1 44.2 "Treating human autoimmunity: current practice and future prospects". Science Translational Medicine. 4 (125): 125sr1. March 2012. doi:10.1126/scitranslmed.3003504. PMC 4061980. PMID 22422994.
- ↑ 45.0 45.1 45.2 "Restoring the balance: immunotherapeutic combinations for autoimmune disease". Disease Models & Mechanisms. 7 (5): 503–13. May 2014. doi:10.1242/dmm.015099. PMC 4007402. PMID 24795433.
- ↑ "PPAR-delta senses and orchestrates clearance of apoptotic cells to promote tolerance". Nature Medicine. 15 (11): 1266–72. November 2009. doi:10.1038/nm.2048. PMC 2783696. PMID 19838202.
{{cite journal}}: Invalid|display-authors=6(help) - ↑ "Autoimmune kidney disease and impaired engulfment of apoptotic cells in mice with macrophage peroxisome proliferator-activated receptor gamma or retinoid X receptor alpha deficiency". Journal of Immunology. 186 (1): 621–31. January 2011. doi:10.4049/jimmunol.1002230. PMC 4038038. PMID 21135166.
{{cite journal}}: Invalid|display-authors=6(help) - ↑ "Genes, tolerance and systemic autoimmunity". Autoimmunity Reviews. 11 (9): 664–9. July 2012. doi:10.1016/j.autrev.2011.11.017. PMC 3306516. PMID 22155015.
- ↑ "Disruption of the cytoskeleton after apoptosis induction with autoantibodies". Autoimmunity. 36 (3): 183–9. May 2003. doi:10.1080/0891693031000105617. PMID 12911286.
- ↑ "Haematopoietic stem cell transplantation for autoimmune diseases". Nature Reviews. Rheumatology. 13 (4): 244–256. April 2017. doi:10.1038/nrrheum.2017.7. PMID 28228650.
- ↑ Drew, Liam (2021-07-14). "How stem cells could fix type 1 diabetes". Nature (in ഇംഗ്ലീഷ്). 595 (7867): S64–S66. Bibcode:2021Natur.595S..64D. doi:10.1038/d41586-021-01842-x. PMID 34262205.
- ↑ "Glycans in the immune system and The Altered Glycan Theory of Autoimmunity: a critical review". Journal of Autoimmunity. 57: 1–13. February 2015. doi:10.1016/j.jaut.2014.12.002. PMC 4340844. PMID 25578468.
{{cite journal}}: Invalid|display-authors=6(help) - ↑ "Hygiene hypothesis and autoimmune diseases". Clinical Reviews in Allergy & Immunology. 42 (1): 5–15. February 2012. doi:10.1007/s12016-011-8285-8. PMID 22090147.
- ↑ 54.0 54.1 54.2 54.3 54.4 54.5 54.6 Harrison, Stephanie R.; Li, Danyang; Jeffery, Louisa E.; Raza, Karim; Hewison, Martin (January 2020). "Vitamin D, Autoimmune Disease and Rheumatoid Arthritis". Calcified Tissue International (in ഇംഗ്ലീഷ്). 106 (1): 58–75. doi:10.1007/s00223-019-00577-2. ISSN 0171-967X. PMC 6960236. PMID 31286174.
- ↑ 55.0 55.1 Lucas, Robyn; Rodney Harris, Rachael (12 August 2018). "On the Nature of Evidence and 'Proving' Causality: Smoking and Lung Cancer vs. Sun Exposure, Vitamin D and Multiple Sclerosis". International Journal of Environmental Research and Public Health. 15 (8): 1726. doi:10.3390/ijerph15081726. PMC 6121485. PMID 30103527.
{{cite journal}}: CS1 maint: unflagged free DOI (link)
കൂടുതൽ വായനയ്ക്ക്
[തിരുത്തുക]- Kumar V, Abbas AK, Fausto N, Aster J (2010). Robbins and Cotran Pathologic Basis of Disease (8th ed.). Elsevier. p. 1464. ISBN 978-1-4160-3121-5.
- Asherson R (ed.). Handbook of Systemic Autoimmune Diseases. Elsevier.
പുറം കണ്ണികൾ
[തിരുത്തുക]| Classification | |
|---|---|
| External resources |
