കാൽസ്യം ഓക്സൈഡ്
| |

| |
| Names | |
|---|---|
| IUPAC name
Calcium oxide
| |
| Other names
Quicklime, burnt lime, unslaked lime, pebble lime
| |
| Identifiers | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.013.763 |
| E number | E529 (acidity regulators, ...) |
PubChem CID
|
|
| RTECS number |
|
| UNII | |
| UN number | 1910 |
CompTox Dashboard (EPA)
|
|
| InChI | |
| SMILES | |
| Properties | |
| CaO | |
| Molar mass | 56.0774 g/mol |
| Appearance | White to pale yellow/brown powder |
| Odor | Odorless |
| സാന്ദ്രത | 3.34 g/cm |
| ദ്രവണാങ്കം | |
| ക്വഥനാങ്കം | 3,850 °C (6,960 °F; 4,120 K) (100 hPa)[1] |
| Reacts to form calcium hydroxide | |
| Solubility in Methanol | Insoluble (also in diethyl ether, n-octanol) |
| Acidity (pKa) | 12.8 |
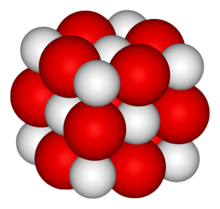
| Structure | |
| NaCl | |
| Thermochemistry | |
Std molar
entropy (S⦵298) |
40 J·mol−1·K−1[3] |
Std enthalpy of
formation (ΔfH⦵298) |
−635 kJ·mol−1[3] |
| Pharmacology | |
| QP53AX18 (WHO) | |
| Hazards | |
| NFPA 704 (fire diamond) | |
| Flash point | Non-flammable [4] |
| NIOSH (US health exposure limits): | |
PEL (Permissible)
|
TWA 5 mg/m3[4] |
REL (Recommended)
|
TWA 2 mg/m3[4] |
IDLH (Immediate danger)
|
25 mg/m3[4] |
| Safety data sheet (SDS) | Hazard.com |
| Related compounds | |
| Other anions | Calcium sulfide Calcium hydroxide |
| Other cations | Beryllium oxide Magnesium oxide Strontium oxide Barium oxide |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
നീറ്റുകക്ക (quicklime or burnt lime) രാസപരമായി കാൽസ്യം ഓക്സൈഡ് (CaO) ആകുന്നു. ഇത് വ്യാപകമായി ഉപയോഗിക്കുന്ന രാസസംയുക്തമാണ്. ഇത് വെളുത്തനിറമുള്ളതും കോസ്റ്റിക് സ്വഭാവമുള്ളതും ആൽകലി സ്വഭാവമുള്ളതും മുറിയിലെ താപനിലയിൽ ക്രിസ്റ്റൽ സ്വഭാവം കാണിക്കുന്ന ഖരവസ്തുവുമാണ്. സിമന്റിൽ കാണപ്പെടുന്ന കാൽസ്യം ഓക്സൈഡിനെ സ്വതന്ത്ര ലൈം എന്നാണു പറയുന്നത്. [5]
താരതമ്യേന വിലകുറഞ്ഞതാണ് ഈ രാസവസ്തു. ഇതും ഇതിന്റെ മറ്റൊരു രൂപമായ കാൽസ്യം ഹൈഡ്രോക്സൈഡും വാണിജ്യപ്രധാനമായ രണ്ടു രാസവസ്തുക്കളാണ്.
നിർമ്മാണം
[തിരുത്തുക]കാൽസ്യം കാർബണേറ്റ് അടങ്ങിയ ((CaCO3 കാൽസൈറ്റ് എന്ന ധാതു)ചുണ്ണാമ്പുകല്ല്, കക്കകൾ എന്നിവ ഒരു ചൂളയിൽ ചൂടാക്കി വിഘടിപ്പിച്ചാണ് കാൽസ്യം ഓക്സൈഡ് നിർമ്മിക്കുന്നത്. 825 ഡിഗ്രിയ്ക്ക് 825 °C (1,517 °F)വേണം ചൂടാക്കാൻ. [6]അതോടെ കാർബൺ ഡൈ ഓക്സൈഡിന്റെ ഒരു തന്മാത്ര സ്വതന്ത്രമാകുന്നു. ബാക്കി ലഭിക്കുന്നത്, നീറ്റുകക്കയാണ്. (CO2); leaving quicklime.
- CaCO3(s) → CaO(s) + CO2(g)
ഇങ്ങനെ ലഭിക്കുന്ന നീറ്റുകക്ക സ്ഥിരതയുള്ളതല്ല. ജലവുമായി ചേർത്ത് ചുണ്ണാമ്പോ കുമ്മായമോ ആക്കാതെയിരുന്നാൽ തണുപ്പിക്കുമ്പോൾ ഇതു പെട്ടെന്നുതന്നെ, അന്തരീക്ഷത്തിലെ കാർബൺ ഡയോക്സൈഡുമായി CO2പ്രവർത്തിക്കുകയും തിരികെ കാൽസ്യം കാർബണേറ്റായി മാറുകയും ചെയ്യുന്നു.
വാർഷികമായി ഈ രാസവസ്തു ലോകത്ത് ഏതാണ്ട്, 28,30,00,00,00 ടൺ ഉല്പാദിപ്പിച്ചുവരുന്നുണ്ട്. ചൈനയാണ് നീറ്റുകക്ക ഏറ്റവും കൂടുതൽ ഉല്പാദിപ്പിക്കുന്ന രാജ്യം. രണ്ടാം സ്ഥാനം യു. എസിനാണ്. [7]
ഉപയോഗം
[തിരുത്തുക]- താപം: കുമ്മായ നിർമ്മാണത്തിനു ജലം ചേർക്കുമ്പോൾ നീറ്റുകക്ക അതിയായ താപം പുറത്തു വിടുന്നു. [8]
- CaO (s) + H2O (l) ⇌ Ca(OH)2 (aq) (ΔHr = −63.7 kJ/mol of CaO)ജലസ്വീകരണസമയം ഈ രാസപ്രവർത്തനത്തിൽ താപം പുറത്തു വിടുന്നതിനാൽ ഇത് താപമോചകപ്രവർത്തനമാകുന്നു. ഈ രാസപ്രവർത്തനം ഉഭയദിശയിലുള്ളതാണ്. നന്നായി ചൂടാക്കിയാൽ സകാൽസ്യം ഓക്സൈഡ് തിരികെ ലഭിക്കുന്നതാണ്. ഒരു ലിറ്റർ വെള്ളം 3.1 കിലോഗ്രാം 3.1 കിലോഗ്രാം (110 oz)നീറ്റുകക്കയുമായിചേർന്ന് കാൽസ്യം ഹൈഡ്രോക്സൈഡിനൊപ്പം 3.54 മെഗ ജൂൾ താപം ലഭിക്കും. ഈ താപം ഉപയോഗിച്ച് അഹാരം പാകം ചെയ്യാൻ ഉപയോഗിക്കാറുണ്ട്. കൊണ്ടു നടക്കാവുന്ന ഒരു ഊർജ്ജ സ്രോതസ്സായി ഇതിനെ കരുതാം.
- പ്രകാശം: ഇത് 2400 ഡിഗ്രി സെന്റീഗ്രേഡുവരെ2,400 °C (4,350 °F) ചൂടാക്കിയാൽ ഒരു ശക്തമായ തിളക്കമുള്ള പ്രകാശം ലഭിക്കും പഴയകാലത്ത് വൈദ്യുതി കണ്ടുപിടിക്കുന്നതിനു മുൻപ് ഈ ലൈം ലൈറ്റ് ഉപയോഗിച്ചായിരുന്നു. തിയേറ്ററുകൾ പ്രകാശിപ്പിച്ചിരുന്നത്. [9]
- സിമന്റ്: സിമന്റ് ഉല്പാദനത്തിനുവേണ്ട ഏറ്റവും പ്രധാന ചേരുവകളിൽ ഒന്നാണ് ഇത്.
- ബയോഡീസൽ ഉല്പാദനത്തിൽ ഉപയോഗിക്കുന്ന ഉൽപ്രേരകത്തിലൊന്നാണിത്. [10][11]
- പെട്രോളിയം വ്യവസായത്തിൽ ഇന്ധനടാങ്കിൽ ജലസാന്നിദ്ധ്യമുണ്ടോ എന്നറിയാനുള്ള വാട്ടർ ഡിറ്റക്ഷൻ പേസ്റ്റിൽ കാൽസ്യം ഓക്സൈഡും ഫിനോൾഫ്തലീനും ആണുള്ളത്. ടാങ്കിൽ ജലം ഉണ്ടെങ്കിൽ ജലവുമായി കാൽസ്യം ഓക്സൈഡ് പ്രവർത്തിച്ച് ശക്തിയേറിയ ആൽക്കലിയായ കാൽസ്യം ഹൈഡ്രോക്സൈഡ് ഉണ്ടാകുന്നു. ഇത് കൂടെയുള്ള ഫിനോൾഫ്തലീനുമായിചേരുമ്പോൾ പർപ്പിൾ നിറം കാണിക്കും. ഇങ്ങനെ റ്റാങ്കിൽ ജലസാന്നിദ്ധ്യം അറിയാനാകും.
- പേപ്പർ: പേപ്പർ വ്യവസായത്തിൽ ഇത് ഉപയൊഗിക്കുന്നു.
- തേപ്പിന്: തറയും ഭിത്തിയും തേച്ച് മിനുക്കാൻ ഇന്നത്തെ സിമന്റിനു പകരം ചരിത്രാതീത കാലം തൊട്ടേ ഇതുപയോഗിച്ചിരുന്നു. [12]
രാസവ്യവസായത്തിലും ഊർജ്ജവ്യവസായത്തിലും കാൽസ്യം ഓക്സൈഡ് അനിവാര്യമായ രാസവസ്തുവാണ്.
ആയുധമായി
[തിരുത്തുക]പഴയകാലത്ത് ശത്രുക്കളെ അന്ധരാക്കാനായി ഇത് കലക്കി ഒഴിച്ചു. ഗ്രീക്ക് തീ ഉണ്ടാക്കാൻ ഇത് ഉപയോഗിച്ചു. ജലവുമായി പ്രവർത്തിച്ചാൽ 150 ഡിഗ്രി ചൂട് ഇതിനുണ്ടാക്കാൻ കഴിയും.
ആരോഗ്യത്തെ ബാധിക്കുന്നു
[തിരുത്തുക]ജലവുമായി ശക്തമായി പ്രവർത്തിക്കുന്നതിനാൽ ഇത് ശ്വസിച്ചാലും തൊലിയിലോ കണ്ണിലോ വീണാലും അസ്വസ്ഥതയുണ്ടാക്കും. അകത്തേയ്ക്കു ശ്വസിക്കുന്നത്, ചുമയ്ക്കും തുമ്മലിനും ശ്വാസമ്മുട്ടലിനും കാരണമാകാം. ഇത്, വയറുവേദനയ്ക്കും ഛർദ്ദിക്കും കാരണമാകാം. ജലവുമായുള്ള ഇതി ശക്തമായ പ്രവർത്തനം ഉല്പാദിപ്പിക്കുന്ന ചൂട് ഇന്ധനങ്ങൾ കത്തുന്നതിനും അങ്ങനെ തീപ്പിടുത്തത്തിനും കാരണമാകാം. [13]
അവലംബം
[തിരുത്തുക]- ↑ Calciumoxid Archived 2013-12-30 at the Wayback Machine. GESTIS database
- ↑ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, Florida: CRC Press. p. 4.55. ISBN 1-4398-5511-0.
- ↑ 3.0 3.1 Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. ISBN 0-618-94690-X.
- ↑ 4.0 4.1 4.2 4.3 NIOSH Pocket Guide to Chemical Hazards. "#0093". National Institute for Occupational Safety and Health (NIOSH).
- ↑ "free lime" Archived 2017-12-09 at the Wayback Machine. DictionaryOfConstruction.com.
- ↑ Merck Index of chemicals and Drugs , 9th edition monograph 1650
- ↑ Miller, M. Michael (2007). "Lime". Minerals Yearbook (PDF). U.S. Geological Survey. p. 43.13. Archived from the original (PDF) on 2017-05-14. Retrieved 2016-01-10.
- ↑ Collie, Robert L. "Solar heating system" യു.എസ്. പേറ്റന്റ് 39,55,554 issued May 11, 1976
- ↑ Gray, Theodore (September 2007). "Limelight in the Limelight". Popular Science: 84. Archived from the original on 2008-10-13. Retrieved 2016-01-10.
- ↑ Kouzu, M.; Kasuno, T.; Tajika, M.; Sugimoto, Y.; Yamanaka, S.; Hidaka, J. (2008). "Calcium oxide as a solid base catalyst for transesterification of soybean oil and its application to biodiesel production". Fuel. 87 (12): 2798. doi:10.1016/j.fuel.2007.10.019.
- ↑ Zhu, H.; Wu, Z.; Chen, Y.; Zhang, P.; Duan, S.; Liu, X.; Mao, Z. (2006). "Preparation of Biodiesel Catalyzed by Solid Super Base of Calcium Oxide and Its Refining Process". Chinese Journal of Catalysis. 27 (5): 391. doi:10.1016/S1872-2067(06)60024-7.
- ↑ Neolithic man: The first lumberjack?. Phys.org (August 9, 2012). Retrieved on 2013-01-22.
- ↑ CaO MSDS. hazard.com
- Pages using the JsonConfig extension
- Articles without EBI source
- Articles without KEGG source
- Articles with changed CASNo identifier
- Chembox and Drugbox articles with a broken CheMoBot template
- ECHA InfoCard ID from Wikidata
- E number from Wikidata
- Pages using Chembox with unknown parameters
- കാൽസ്യം സംയുക്തങ്ങൾ

